在生物学的世界里,基因编辑技术一直是科学家探索的热门领域,近年来,CRISPR-Cas系统的发现和研究为基因编辑带来了革命性的变化。CRISPR-Cas系统为原核生物提供了RNA引导的适应性免疫应答,以抵御入侵的可移动基因元件,如病毒基因组、外源质粒等。Class 1 CRISPR-Cas系统中的type I系统是细菌和古细菌中分布最广泛的类型。传统的type I系统利用 crRNA-guided Cascade复合物以及标志性的Cas3蛋白(helicase - nuclease)来实现顺序的靶标DNA识别和降解过程。Cascade复合物的Cas8亚基通过识别入侵DNA的PAM序列,促使靶标DNA双链解旋并与crRNA配对形成R-loop结构,随后 Cascade复合物招募Cas3对其进行切割和降解。最近发现的type I-F型变体Cas8-HNH系统与传统的type I系统不同,Cas8-HNH系统缺乏Cas3基因,它将一个 HNH 核酸酶结构域通过 linker 区域自然融合到Cas8亚基上,代替Cas3蛋白履行其职责。
为了阐明 Cas8-HNH 系统切割靶标DNA的分子机制,中国科学院物理研究所/北京凝聚态物理国家研究中心研究团队与合作者通过冷冻电镜技术成功解析了Cas8-HNH系统在不同功能状态下的多个结构。研究团队通过重组Cas8-HNH Cascade复合物获得其在无靶标DNA (apo)、部分 R-loop、完整R-loop和单链 DNA结合状态下的多个冷冻电镜结构。该复合物呈整体G形结构,位于Cas8亚基羧基端的HNH核酸酶结构域通过linker区锚定在复合物的中心。结构和生物学分析表明,完整R-loop的形成对于HNH核酸酶的激活至关重要,同时,HNH结构域的羧基端螺旋可能作为传感器,监测靶标DNA与crRNA配对,并触发HNH结构域进行切割所需的构象重排。同时,该系统不能容忍靶标DNA 前间隔序列中的错配,尤其是在PAM远端位置。与广泛应用于基因编辑的II型 CRISPR-Cas9系统相比,Cas8-HNH系统在 PAM 远端序列对错配的容忍度更低,这意味着它具有更高的精确性,有望成为一种更准确的 DNA 编辑工具。此外,Cas8-HNH系统能够识别CN PAM序列,比传统Type I-F系统中的CC PAM和链球菌Cas9系统中的 NGG PAM 更具灵活性,具有更广泛的靶向范围。未来,我们可以期待基于 Cas8-HNH系统开发出更高效、更精确的 DNA 编辑工具,为生物医学研究和疾病治疗带来更多的可能性。
本工作受到国家基金委和中国科学院的资助。中国科学院物理研究所软物质与生物物理实验SM10组朱洪涛特聘研究员和天津医科大学基础医学院张恒教授为论文的共同通讯作者。天津医科大学基础医学院李徐梓超博士、中国科学院物理研究所博士后刘亚男博士、天津医科大学研究生韩洁、张灵灵为本文共同第一作者。该成果以“Structural basis for the type I-F Cas8-HNH system”为题发表在著名分子生物学杂志EMBO Journal杂志。
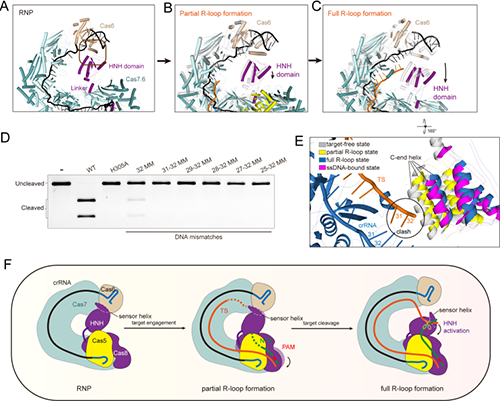
图 Cas8-HNH系统切割靶标DNA的分子机制

