真菌同种异体识别是一种关键的生物学机制,能够防止细胞质混合、抵御真菌寄生,并通过诱导细胞溶解性死亡维持种群健康和生态平衡。然而,其分子机制尚未完全阐明。前期研究表明,丝状真菌粗糙脉孢菌(Neurospora crassa)中的基因RCD-1在不同菌株中编码两种同源蛋白,即RCD-1-1和RCD-1-2。当不同菌株发生细胞融合时,这两种蛋白介导同种异体识别并触发细胞死亡。尽管RCD-1蛋白与哺乳动物Gasdermin(GSDM)家族的膜打孔结构域具有相似的结构特征,但其均缺乏自抑制功能的结构元件。因此,RCD-1蛋白如何诱导细胞溶解性死亡,是否通过类似于GSDM的膜打孔机制发挥作用,以及其具体分子机制,仍是亟待解决的科学问题。
中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室焦放特聘研究员(SM6组)致力于开发和应用新型多功能高速原子力显微镜(HS-AFM, 水平分辨率~1nm,垂直分辨率~0.1nm,成像速度达20帧/秒)技术,研究生物大分子(如MACPF/CDC成孔蛋白、焦亡蛋白、多肽、骨架蛋白及光合蛋白复合物等)在准生理环境中的高分辨结构、动态行为、自组装及相互作用机制。
近期,该团队利用原子力显微镜分析了RCD-1孔的高分辨结构,揭示了RCD-1-1与RCD-1-2必须形成异质二聚体才能被激活,进而在细胞膜表面形成孔状结构。此外,研究首次发现RCD-1不仅能够形成孔道,还可在特定条件下诱导细胞膜发生鼓包形变,这一现象在GSDM家族蛋白中尚属首次报道。通过设计一系列不同组分的人工磷脂膜实验,研究进一步证实RCD-1诱导的细胞膜鼓包现象与膜组分及其弯曲模量密切相关。综上所述,该研究不仅揭示了RCD-1蛋白的双重功能—膜打孔与膜弯曲调控,还提示这一机制可能在GSDM家族蛋白中具有普遍性,为理解真菌同种异体识别及细胞死亡机制提供了新的视角。
相关研究工作以“Mechanisms of RCD-1 pore formation and membrane bending”为题发表在Nature Communications [Nat Commun 16, 1011 (2025)]上,中国科学院物理研究所博士后任克礼为第一作者,焦放特聘研究员为通讯作者,合作团队还包括中国科学院生物物理研究所丁璟珒研究员、中国科学院物理研究所叶方富研究员等。此项研究受到了国家自然科学基金委和中国科学院的资助支持。
文章链接:https://www.nature.com/articles/s41467-025-56398-5
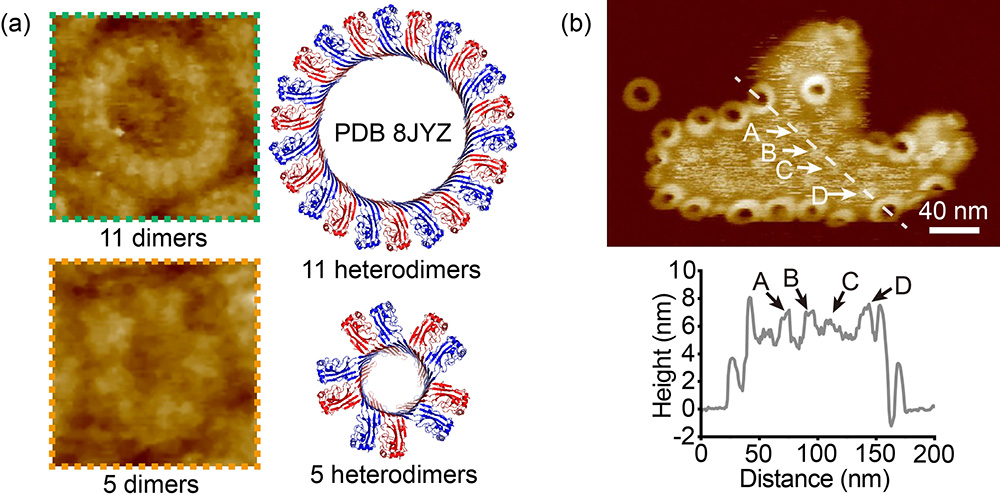
图:(a) RCD-1孔的高分辨结构。(b) RCD-1诱导磷脂膜鼓包结构的高分辨成像。

